A Química, com suas fórmulas e reações, pode ser um desafio e tanto para muitos estudantes. Quem nunca se viu às voltas com a tabela periódica, tentando entender as ligações entre os átomos? É uma matéria que, se não estivermos preparados, pode realmente tirar o nosso sono.
Neste artigo, vamos descomplicar e focar em um ponto crucial: as ligações químicas. Vamos mostrar de forma simples e direta quais são os tipos de ligações que existem, suas características e funções. Assim, você nunca mais vai errar nas provas e vai entender de uma vez por todas como os átomos se unem para formar moléculas. Vamos nessa?
Conteúdo
O que são as ligações químicas?
As ligações químicas são essenciais para entendermos como os átomos se unem para formar substâncias e compostos. Elas são as forças que mantêm os átomos unidos e determinam as propriedades das substâncias.
““Ligação química” foi um termo usado pela primeira vez por Gilbert Newton Lewis no ano de 1920 em um artigo para explicar por que os átomos se mantêm unidos para formar as substâncias e também por que eles permanecem unidos ao longo de milhares de anos.”
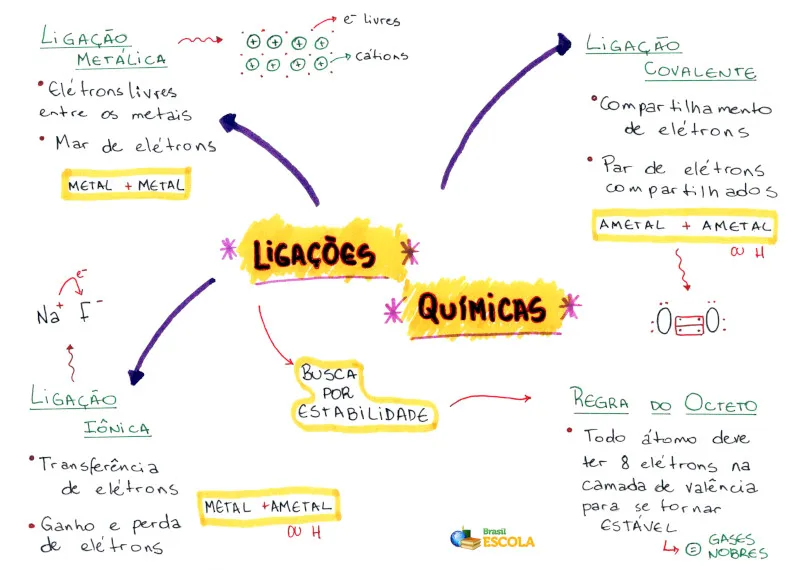
De acordo com a ligação química realizada é que podemos classificar as substâncias. Os compostos iônicos são formados pelas ligações iônicas, as moléculas são formadas pelas ligações covalentes e os metais são formados pelas ligações metálicas. Elas também diferem quanto à força: a ligação metálica é mais forte, sendo sucedida pela ligação iônica e então a covalente.
Então, vamos conhecer melhor cada uma dessas ligações:
Ligação Covalente
A ligação covalente é um tipo de ligação química em que os átomos compartilham pares de elétrons para alcançar a estabilidade eletrônica. Essa ligação ocorre entre átomos de elementos não metálicos, que têm tendência a ganhar, perder ou compartilhar elétrons para atingir a configuração eletrônica dos gases nobres, que possuem uma camada de valência completa.
No caso da ligação covalente, os átomos compartilham os elétrons de forma que cada átomo contribui com um ou mais elétrons para formar os pares compartilhados. Esse compartilhamento de elétrons resulta na formação de moléculas estáveis.
Um exemplo clássico de ligação covalente é a molécula de água (H2O), em que dois átomos de hidrogênio compartilham seus elétrons com um átomo de oxigênio. Cada átomo de hidrogênio fornece um elétron, e o oxigênio fornece dois elétrons, formando assim dois pares de elétrons compartilhados, o que resulta na molécula de água estável.
Ligação Iônica
A ligação iônica é um tipo de ligação química que ocorre entre átomos de elementos com grande diferença de eletronegatividade, resultando na transferência de elétrons de um átomo para outro. Isso ocorre entre um metal e um não metal, ou entre um metal e um radical (grupo de átomos que possui carga elétrica).
Neste tipo de ligação, um átomo perde elétrons para se tornar um íon positivo (cation) e outro átomo ganha elétrons para se tornar um íon negativo (ânion). Os íons de cargas opostas se atraem eletricamente, formando uma ligação forte e estável.
Um exemplo clássico de ligação iônica é o cloreto de sódio (NaCl), mais conhecido como sal de cozinha. Neste composto, o sódio (Na) perde um elétron para se tornar Na+ e o cloro (Cl) ganha esse elétron para se tornar Cl-, formando assim o composto NaCl, onde os íons Na+ e Cl- se atraem eletricamente, resultando numa ligação iônica.
Nesse exemplo, fica mais claro ver o sódio que doa (seta vermelha) um elétron para o cloro, formando o sal, uma substância muito estável. Visto que se formam (seta preta) íons, que são espécies químicas com cargas opostas (+ e -), um íon atrai outro próximo e são formados aglomerados iônicos com um número enorme de íons, como são os cristais do sal de cozinha.
Ligação Metálica
A ligação metálica é um tipo de ligação química que ocorre em metais. Neste tipo de ligação, os átomos de metal compartilham seus elétrons de valência, formando uma “nuvem” de elétrons deslocalizados que se movem livremente entre os átomos metálicos.
Essa “nuvem” de elétrons deslocalizados é responsável por várias propriedades características dos metais, como a condutividade elétrica e térmica, a maleabilidade (capacidade de ser moldado) e a ductilidade (capacidade de ser transformado em fios).
Um exemplo comum de ligação metálica é o ferro (Fe). Nos metais, os átomos estão dispostos em uma estrutura cristalina, e os elétrons de valência podem se mover livremente através dessa estrutura, permitindo a condução de eletricidade e calor. Essa mobilidade dos elétrons também explica a capacidade dos metais de serem moldados e transformados em fios.
A ligação metálica é caracterizada pelo compartilhamento de elétrons de valência entre átomos metálicos, formando uma “nuvem” de elétrons deslocalizados que conferem propriedades únicas aos metais.

Exercícios
Agora que você está por dentro das principais ligações químicas, hora de colocar seus conhecimentos em prática! E nada melhor do que questões sobre o assunto, para entender o seu nível de domínio.
A Estuda.com tem um banco com mais de 190 mil questões disponíveis e muitas delas são sobre essa temática que cai muito no ENEM! Você pode filtrar pelos níveis fácil, médio e difícil e avançar por cada etapa, sempre que se sentir confiante de testar seus conhecimentos.
Comece a praticar agora! Separamos uma lista para você iniciar os seus estudos sobre ligações químicas. Clique aqui para acessar a lista de questões da Estuda.com.